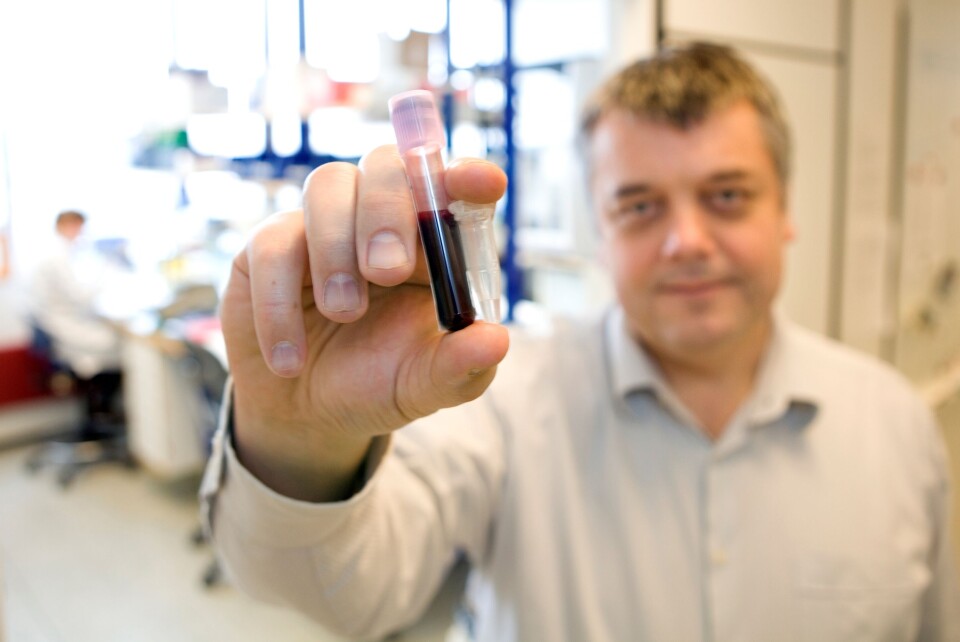
– En liten DNA-revolusjon
Forskerne kjenner nå til nesten 30 ganger så mange sykdomsutløsende gener som for ti år siden. Utviklingen skaper enorme muligheter for framtidas helsetilbud, mener genetiker.
Denne artikkelen er over ti år gammel og kan inneholde utdatert informasjon.
Kroppens evne til å bekjempe sykdom er i betydelig grad bestemt av hva slags individuelle genetiske variasjoner vi er utrustet med.
Også kroppens evne til å nyttiggjøre seg og tåle medisiner varierer fra person til person.
- Veldig mye av det som blir gjort i helsevesenet i dag, baserer seg imidlertid på grove kategoriseringer av pasienter, sekkediagnoser og behandling på gruppenivå.
- Resultatet blir ofte ineffektiv behandling og mange bivirkninger, påpeker Dag Undlien, professor i medisk genetikk ved Universitetet i Oslo.
I Norge er han en av frontfigurene for innføringen av det motsatte: individuelt tilpasset medisin, ofte kalt skreddersydd medisin. Teknologien har gjort det mulig å finne ut stadig mer om genene våre.
Resultatet vil bli bedre diagnostikk og bedre behandling både for arvelige sykdommer og for mer vanlige sykdommer, som folkesykdommer, ifølge Undlien.
Tester flere sjeldne sykdommer
For ti år siden hadde forskerne kartlagt 100 gener som alene kan utløse arvelig sykdom. Nå kjenner forskerne til 2850 slike gener.
- Vi vet at disse genene utløser ulike arvelige sykdommer hvis de er skadet. Her snakker vi om sykdommer som alltid skyldes feil i ett bestemt gen. Ved å utvikle verktøy som ser spesifikt på disse, blir det mulig å stille en eventuell diagnose, forklarer han.
Fram til for noen få år siden omfattet testingen av sjeldne sykdommer hos nyfødte i Norge stort sett bare stoffskiftesykdom og Føllings sykdom, som fører til mental retardasjon hvis den ikke oppdages og behandles raskt etter fødsel.
I dag testes nyfødte for mer enn 20 arvelige sykdommer, som det også finnes behandlinger for.
- Flesteparten av de 2800 genfeilene er det ikke umiddelbart enkelt å utvikle behandling for, men vi har kommet mye nærmere, sier Undlien.
Ditt genom for 100 dollar
I 2001 presenterte forskere det første utkastet av det humane genom, det vil si hele den arvemessige informasjonen som er kodet inn i DNA-et vårt. Genomet består blant annet av mellom 20 000 og 30 000 gener.
Det er bare ørsmå forskjeller i arvematerialet som gjør at vi mennesker blir forskjellige, men disse forskjellene kan være avgjørende for om vi får en sykdom eller ikke.
- Hittil har det å kartlegge genomet til enkeltpersoner vært uoverstigelig ressurskrevende og dermed fungert som en hemsko for å generere den kunnskapen man trenger. Men teknologiutviklingen åpner for nye muligheter, påpeker Undlien.
- Vår evne til å studere DNA-molekylet har gjennomgått en liten revolusjon de aller siste årene, og vi har teknologi som er mange millioner ganger mer effektiv enn for få år siden. Mange ser for seg at en slik kartlegging om ikke mange år kan komme ned i en pris på under 100 dollar.
Undlien og andre som jobber med medisinsk genetikk, møter ofte pasienter med tegn på sjeldne, genetisk betingede sykdommer som de ikke klarer å finne den genetiske årsaken til og ikke vet hvor de skal lete.
- Nå er teknologien så kraftig at bare vi har et par pasienter i en familie, kan vi sekvensere alle genene deres.
- Ved Oslo universitetssykehus gjennomfører vi dette foreløpig i et forskningsprosjekt, men jeg er sikker på at det etter hvert vil bli et fast tilbud til utvalgte pasientgrupper, sier han.
Han tror også folk flest etter hvert vil kunne ta en gentest på et tidlig stadium i livet og undersøke hele arveanlegget. Deretter kan vi se for oss at informasjonen ligger lagret hos legen slik at helsevesenet alltid vil ha alle våre genetiske data tilgjengelig.
Sammensatte folkesykdommer
Men hva med mer genetisk komplekse sykdommer, for eksempel de klassiske folkesykdommene som diabetes, hjerte- og karsykdommer og beinskjørhet?
Her er det som regel flere gener som spiller inn, i kombinasjon med miljøet, og det er som regel ikke snakk om genfeil, men normalvariasjon av gener som har betydning.
I dag kjenner forskerne til 1100 slike sårbarhetsgener, sammenlignet med bare et dusin for rundt ti år siden. Disse genvariantene er funnet ved at forskere har undersøkt og sammenlignet varianter i alle genene hos større grupper friske og syke personer for å lete etter mønstre som er forbundet med sykdom
- Risikoen forbundet med de enkelte genvariantene som disponerer for utvikling av sykdom, er mye lavere her enn for de sterkt arvelige sykdommene.
- Effekten av variasjon på det enkelte gen vil være så liten at det ofte ikke gir informasjon som legen kan nyttiggjøre seg i behandling. Derfor er hittil få av disse tatt i rutinemessig bruk i diagnostikk, sier Undlien.
Fant fedmegen

Fra sin egen forskningskarriere har han et favoritteksempel på hva skreddersydd medisin kan gjøre. Historien begynner med en tre år gammel gutt som er 42 kilo, nesten tre ganger som tung som sine jevnaldrende.
Fire år senere har gutten i stedet for å legge på seg slik barn gjør når de vokser, gått ned ti kilo og blitt slank. Hva har skjedd?
En gruppe i England forsket seg fram til at feilen lå i et gen som styrer produksjonen av et hormon som gir metthetsfølelse. Gutten manglet dette viktige hormonet, og resultatet ble overspising og alvorlig overvekt.
- Ved å lage dette hormonet i laboratoriet og gi det til gutten i form av daglige sprøyter, ble vekten fullstendig normalisert, forklarer Undlien.
I samarbeid med forskerne i England fant hans forskningsgruppe bestemte feil i et annet gen som også fører til at pasientene ikke har normal metthetsfølelse.
I løpet av de siste ti årene har forskere funnet ut at hos en av hundre med alvorlig fedme er forklaringen feil i ett enkelt gen.
Mange så for seg at hormonet som regulerer metthetsfølelsen, kunne revolusjonere slankeindustrien. Men så enkelt var det ikke.
- Dette er en klassisk illustrasjon på at det som er en løsning for noen, ikke er en løsning for andre. For den lille gutten var det kanskje livreddende. De fleste av oss produserer imidlertid dette hormonet, og å tilføre mer av det, har liten effekt, påpeker Undlien.
Spyttprøve til Island
Nye teknologier og muligheter byr også på nye utfordringer. Når enorme mengder data undersøkes med avanserte metoder, kan man lett finne ting man i utgangspunktet ikke tok sikte på å finne. Hva gjør man da?
- Mange vil nok mene at dersom en sykdom kan forebygges, vil pasienten ønske beskjed om det, mens meningene vil være mer delte hvis det ikke er mulig å forebygge. Folks rett til ikke å vite er et grunnleggende prinsipp.
- Dette er utfordrende problemstillinger som de medisinske miljøene må finne gode løsninger på, sier Undlien.
Han mener imidlertid det er viktig å klare å ha to tanker i hodet på en gang og ikke tro at utfordringen kan løses bare ved å være restriktiv. Vi må ta hensyn til alle muligheter folk kan gå glipp av hvis vi ikke tar dette i bruk i helsevesenet, og vi må se på det som skjer utenfor Norges grenser.
- Det popper opp tilbud i utlandet som vi ikke kan kontrollere – vi kan ikke nekte noen å sende en spyttprøve til Island for å bli kontrollert for sykdom eller sykdomsrisiko.
- Vi risikerer at lovgivingen vår ødelegger mulighetene for å bygge opp et tilbud som er bedre og hvor folk blir fulgt opp på en ordentlig måte, fastslår Undlien.
Lenke:
Forskningsrådets program Funksjonell genomforskning (FUGE)
SE OGSÅ
-

Finne meg selv - i genene
-

Takler genetisk veiledning bra
-
Knekker brystkreftkoden
-

Gener avslører sjeldne sykdommer
-
Hjernebilder gir hele bildet
-

Deprimerte feilmedisineres
-
Skreddersydd og skånsom strålebehandling
-
Fant gener for røykesug
-

Traumatisk oppvekst forkorter livet
-

Mitt liv, mitt gen
-

Kvinner og menn bør få ulike medisindoser
-

Gensekvensering med stormskritt
-

Mener gener?




























