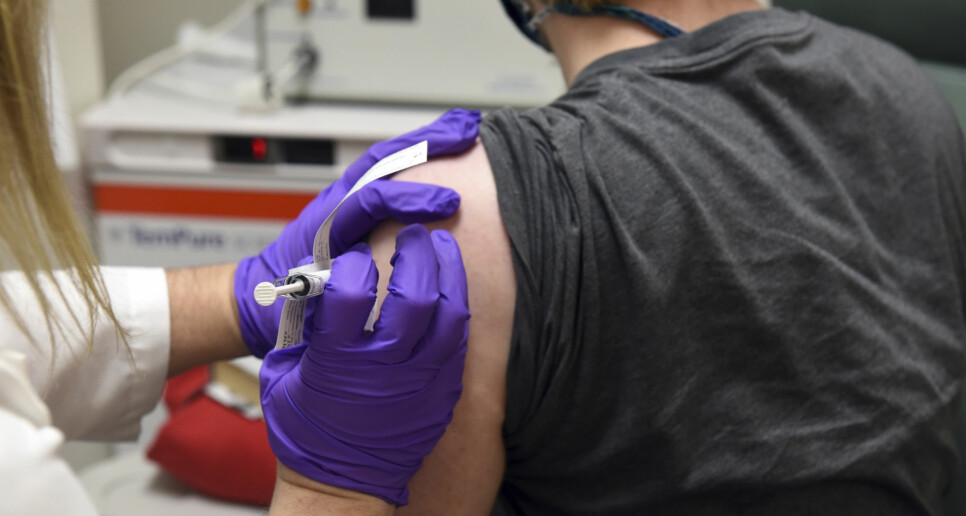
Bildet viser en av de første pasientene som fikk teste vaksinen fra legemiddelgigantene Pfizer og BioNTech i mai. Nye testresultater tyder på at vaksinen er vellykket.
(Foto: University of Maryland School of Medicine / AP / NTB scanpix)
Gladnyhet om vaksine, men når kan den være her?
Verden jubler over positive vaksinenyheter. Men hva betyr det for Norge, og når kan covid-19-vaksinen være på markedet her?
Legemiddelgigantene Pfizer og BioNTech kom mandag med en gladnyhet som umiddelbart sendte børser over hele verden i full fart oppover. Deres vaksine mot covid-19, som for tiden testes ut, har så langt vist seg å beskytte 90 prosent av brukerne mot covid-19, og det er ikke meldt om alvorlige bivirkninger.
Medisinsk fagdirektør Steinar Madsen i Statens legemiddelverk ble både glad og lettet da han hørte nyheten.
– Vi antar i utgangspunktet at en felles europeisk godkjenning av vaksinen kan komme i månedsskiftet januar/februar. På bakgrunn av de dataene vi har fått innsikt ifra firmaet, holder vi alle muligheter åpne, sier han til NTB.
Madsen utelukker heller ikke at vaksinen kan komme før.
WHO: Mye arbeid gjenstår
Pfizer og BioNTech opplyser at de regner med å kunne søke godkjenning for såkalt nødbruk av vaksinen i USA i løpet av den tredje uken i november.
De forventer å kunne tilby rundt 50 millioner doser i 2020, og opptil 1,3 milliarder doser neste år. Vaksinen må tas i to doser over tre uker.
Leder for vaksinearbeid i Verdens Helseorganisasjons (WHO), Bruce Aylward, tror vaksinen kan rulles ut til de mest sårbare i mars neste år, og understreker at dette kan føre til store, fundamentale endringer for forløpet til hele pandemien.
– Det er fortsatt mye arbeid foran oss, og dette er kun foreløpige resultater. Men det er veldig positive resultater som er kommet i dag, som forhåpentligvis er veldig lovende for hele verden, sier han til Reuters mandag.
EU har bestilt 300 millioner doser
Norge har koblet seg på EUs program for koronavaksiner, og vil derfor få vaksinene samtidig som EU-land gjennom en avtale med Sverige.
Det er nå minst ti vaksiner som har nådd fase tre, altså siste testfase før godkjenning, og EU-har sikret seg avtaler med flere av produsentene – inkludert Pfizer og BioNTech som nå har hatt et gjennombrudd.
EU-kommisjonens leder, Ursula von der Leyen, opplyste mandag at kommisjonen snart skal signere en kontrakt med de to selskapene om leveranser på opptil 300 millioner vaksinedoser.
Neste år
Det europeiske legemiddelbyrået EMA sier at de ennå ikke har fått testdata fra Pfizer og BioNTech. De holder fast ved prognoser om at vaksinen kan være godkjent tidlig neste år. Norge er i en felles prosess med EMA når det gjelder godkjenning av vaksinen.
Ettersom flere vaksiner utvikles parallelt, er det heller ikke utenkelig at man kan få flere vaksiner på markedet på samme tidspunkt.
– EU har for eksempel bestilt opptil 400 millioner doser av vaksinen til produsenten AstraZeneca (som er i fase tre). Den vil komme i små volumer i starten, mens man bygger opp kapasiteten. Den første måneden vil Europa kanskje få ti millioner doser, men så ser man for seg at hele leveransen vil være levert i løpet av et halvt år, sa departementsråd Bjørn-Inge Larsen i Helse- og omsorgsdepartementet til NTB tidligere i høst.
Han opplyste at smitten rett og slett vil begynne å dø ut av seg selv når over 50–70 prosent av befolkningen er vaksinert. Det kan ta mellom seks og tolv måneder å få vaksinert så mange.
Brede studier
Den nye vaksinen fra Pfizer og BioNTech er en såkalt mRNA-vaksine.
Dette er helt ny teknologi som i praksis ikke har vært brukt på mennesker før. I motsetning til tradisjonelle vaksiner, baserer den seg ikke på selve viruset, noe som kan gjøre produksjonen mer effektiv.
– Mange tror at denne vil ha mindre bivirkninger enn tidligere vaksiner. Men nettopp fordi dette er nytt, satser man veldig tungt på store studier med mange forsøkspersoner, hvor mellom 20 000 og 60 000 deltar. Slik samler man enormt mye data på bivirkning, virkning og beskyttelse, sier Madsen i Legemiddelverket.
Pfizer og BioNtechs vaksine er testet på over 43 000 personer i USA og andre land.