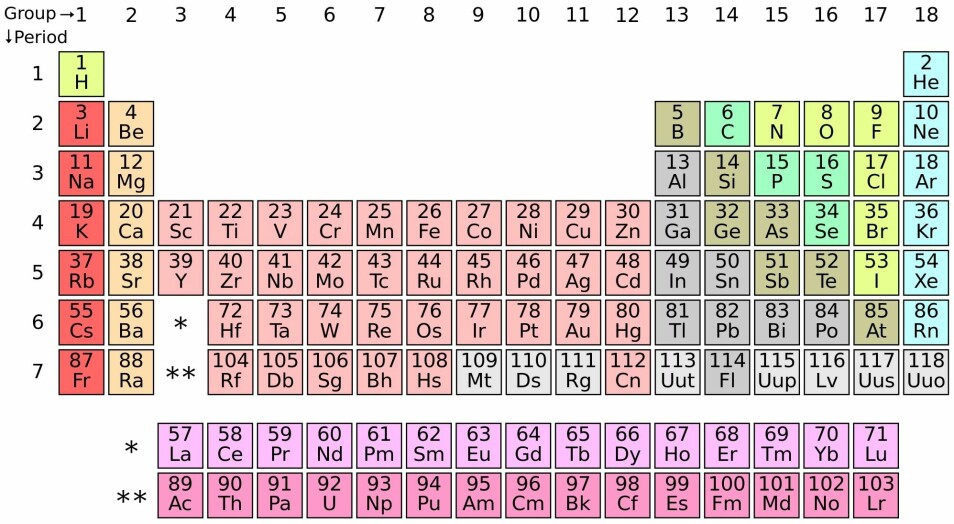
Bakgrunn: Hva er et grunnstoff?
Gull er et eksempel. Det eneste det er satt sammen av, er gullatomer. Vann er ikke et grunnstoff, men en forbindelse, molekyler som igjen er laget av atomer fra grunnstoffene hydrogen og oksygen.
Denne artikkelen er over ti år gammel og kan inneholde utdatert informasjon.
Grunnstoffene er byggeklossene for all masse, og et bestemt grunnstoff er satt sammen av bare en type atom.

Jordkloden er satt sammen av rundt 90 grunnstoff, men bare 25 av dem er byggeklosser for levende organismer. Det er litt som med språket; med bare 29 bokstaver er det mulig å lage alle ordene.
Atomene
Hvert grunnstoff er laget av en bestemt type atom. Atomene er forskjellige og unike, selv om de er laget av de samme bestanddelene. Atomene er de minste partiklene som kan gjenkjennes som et bestemt grunnstoff.
Atomer er uhyre små. Selv med hundre millioner atomer lagt på en rett linje, blir ikke linjen mer enn en cm lang.
Ordet atom kommer fra gresk og betyr udelelig. På et punkt i historien trodde man nemlig at atomet var det minste som eksisterte, og at det ikke kunne deles opp videre. Nå vet vi litt mer.
Elementærpartiklene
I dag snakker vi om elementærpartikler, som er atomets bestanddeler. Et atom er bygd opp av protoner, nøytroner og elektroner. Av disse er det egentlig bare elektronet som kvalifiserer til å være elementærpartikkel, for protonene og nøytronene kan videre deles opp i kvarker.
Det finnes også flere ulike elementærpartikler, utenom kvarker og elektroner, men de hopper vi over i denne sammenhengen.
Et atom består av en kjerne med positiv elektrisk ladning, og et eller flere “skall” av negativt ladde elektroner som surrer i bane rundt kjernen. Atomkjernen består av positivt ladde partikler; protoner, og ikke-ladde partikler; nøytroner.
Elektronene kan bare røre seg i bestemte baner rundt kjernen; ved overgang fra en bane til en annen opptar eller avgir atomet energi.
Ioner
I normal tilstand har et atom like mange protoner som elektroner. Da utligner de positive og negative partiklene hverandre, og atomet har ingen elektrisk ladning.
I den periodiske tabellen har de forskjellige grunnstoffene et atomnummer, som uttrykker antallet positive ladninger i kjernen (protonene), og dermed også antallet elektroner i skallene ved normaltilstand.
Dersom et elektron blir fjernet, har atomet en overskytende positiv ladning, og kalles et ion. Blir det lagt til et elektron, blir atomet et negativt ion.
Molekyler
Atomene kan slutte seg sammen i bestemte grupper, som kalles molekyler. Når et molekyl er satt sammen av forskjellige atomer, er det ikke et grunnstoff. Et grunnstoff karakteriseres av antallet protoner i kjernen, som også gir grunnstoffet sitt atomnummer, som igjen gir stoffet en spesifikk plass i det periodiske system.
Dersom et grunnstoff er elektrisk nøytralt, altså ikke et ion, inneholder det like mange elektroner som atomnummeret. Isotoper er varianter av et grunnstoff hvor antallet nøytroner i kjernen varierer. Et atom med et bestemt antall nøytroner og protoner kalles en nuklide. Summen av antall nøytroner og protoner kalles nukleontallet.
Atomnummer og massetall
Når det kjemiske symbolet for et grunnstoff brukes, blir massetallet angitt oppe til venstre for den kjemiske forkortelsen, og atomnummeret nede til venstre. Atomnummeret utelates ofte fordi dette er implisitt i det kjemiske symbolet.
Protoner og nøytroner er ca 1 800 ganger tyngre enn elektroner, og atomvekten til et stoff er derfor praktisk talt lik vekten av kjernens protoner og nøytroner.
Fordi en kjerne kan ha skiftende antall nøytroner, forekommer de enkelte grunnstoffer i små variasjoner, eller isotoper. Hydrogen har ett proton i kjernen, og atomvekten er 1,0079. Tungt hydrogen har ett proton og ett nøytron og er dobbelt så tungt.
Isotoper
Isotopene har like mange protoner (atomnummeret), men forskjellig antall nøytroner, og får derfor et annet massenummer. Isotopens navn skrives som regel som det kjemiske symbolet fulgt av massenummeret.
Alle grunnstoffer har isotoper, men noen har få, mens andre har mange. Det finnes to typer isotoper; stabile og ustabile. En stabil isotop løser seg ikke opp, og er derfor ikke radioaktiv. En ustabil isotop er radioaktiv, og faller fra hverandre og danner nye grunnstoff.
De fleste grunnstoffer har noen stabile isotoper, som er formen det vanligvis finnes i, og noen ustabile radioaktive isotoper (radioisotoper). Mange av dem blir dannet som et resultat av kjernefisjon.
Å lage isotoper
Jern og bly har for eksempel fire stabile isotoper, og åtte radioaktive isotoper. Mange av elementene i den øvre delen av atomskalaen har bare ustabile isotoper, som uran, radon og plutonium.
Isotoper lages enten ved å bombardere atomer med nøytroner i en kjernereaktor, eller ved akselerere dem i en partikkelakselerator, for så å skyte atompartiklene mot et målmateriale.
Når et nøytron blir absorbert, endres grunnstoffet til et stoff som har høyere atommasse og er ustabilt, og som fort degraderes til en isotop som er stabil. I en akselerator løsrives protoner og nøytroner fra kjernen til partiklene med høy fart, og det dannes isotoper med lavere atomnummer enn målmaterialet.
112 grunnstoffer så langt
Så vidt vi vet, finnes det bare et visst antall grunnstoffer. Frem til i dag har vi oppdaget eller skapt over 100. Selv om det er flere igjen å oppdage, vil de viktigste grunnstoffene være de samme. Jernatomer på jorden er de samme som jernatomer på meteoritter. Jernatomene som gjør at planeten Mars ser rød ut, er også de samme.
De første 18 grunnstoffene i den periodiske tabellen står for størstedelen av massen i universet. Elektronene deres plasser fint inn i tre skall. Til sammen kjenner vi til 92 forskjellige grunnstoff som finnes naturlig, og mange av dem er kjente, som for eksempel kobber, jern, karbon, bly eller uranium. Grunnstoffer kan være gass, i fast form, eller flytende.
Men i tillegg kommer noen som man har klart å se i laboratorieforsøk, slik at 112 grunnstoffer er kjent i dag.
Godt forklart om grunnstoff og mer: CHEM4KIDS
SE OGSÅ
-

Atomkjernen - rødere enn ventet
-
Grunnstoff nr. 117 har sett dagens lys
-

Jakten på verdens tyngste grunnstoff
-

Gull og sølv i kloakken
-

Offisielle navn til grunnstoff 113, 115, 117 og 118
-
Verdens tyngste grunnstoff bekreftet
-

Søvnens mysterium kan oppklares av nyoppdaget molekyl
-
Molekylene som får sår til å gro
-
Fant molekyl som kan bremse munnhulekreft




























